
Recherche Scientifique VIH
BIOSANTECH, créée en avril 2011 par Roger et Corinne TREGER est une entreprise innovante basée à Sophia Antipolis Valbonne en région Provence-Alpes Cote d’Azur.
BIOSANTECH a pour but de promouvoir et de développer un vaccin efficace sur tous les variants du virus du SIDA.
BIOSANTECH possède un accord exclusif de coopération avec le CNRS et l’université d’Aix Marseille et est propriétaire de la licence exclusive de valorisation et de commercialisation des brevets du CNRS concernant la TAT oyi. BIOSANTECH, possède à ce jour le vaccin thérapeutique le plus avancé au monde à avoir été autorisé à passer en phase II sur III nécessaire à sa commercialisation. Les résultats de la preuve de l’efficacité du vaccin sur des patients infectés par le SIDA sont en cours.
CAUTION SCIENTIFIQUE DU PROJET
Le projet de BIOSANTECH a reçu le soutien de l’Institut International pour le Développement et le Soutien en Recherche Innovante (IIDSRSI) dirigé par Michel-Paul Correa et de son comité scientifique présidé par le Pr CHERMANN qui est constitué de 13 chercheurs et experts reconnus à l’International.
Le Docteur JEAN DE MAREUIL, immunologue et virologue est le conseiller scientifique du projet pour Biosantech et a la charge d’analyser les données biologiques à partir des sérums prélevés sur les patients vaccinés.
Un espoir pour un vaccin thérapeutique contre le SIDA
Le 2 décembre 2013 - Actu, Biosantech
Vaccin
C’est une solution moins onéreuse que la trithérapie qui nécessite un traitement quotidien, car trois injections du vaccin suffiraient pour stabiliser l’état d’un patient quelque soit son pays de naissance et son accès aux soins. Il faut noter aussi que les enfants ne peuvent être soignés avec la trithérapie, condamnant ceux dont la mère n’a pas reçu de trithérapie pendant les derniers mois de sa grossesse.
HIV, un vaccin thérapeutique à l’essai
Le 2 décembre 2013 - Biosantech, Informations, News, Programmes
Biosantech Logo
À Marseille, les premières doses d’un vaccin thérapeutique contre le VIH ont été injectées à des patients dans le cadre d’un essai clinique qui doit se poursuivre jusqu’en juin 2015. Il faudrait attendre plusieurs années pour qu’un tel vaccin puisse être commercialisé, mais cette solution thérapeutique paraît désormais accessible.
Par Pedro Lima, le 18/04/2013
Le 8 avril dernier, au centre d’investigation clinique de l’hôpital de la Conception à Marseille, deux patients infectés par le virus VIH ont reçu la première dose d’un vaccin thérapeutique, dans le cadre d’un essai clinique destiné à valider son efficacité. Les injections vont se poursuivre au rythme de trois nouveaux patients par semaine, pour atteindre un total de 48 volontaires, répartis en quatre groupes : trois groupes recevront trois injections du vaccin à des doses différentes (11, 33 et 99 microgrammes de principe actif), le quatrième recevra un placebo. Objectif de l’essai, autorisé le 24 janvier dernier par l’Agence nationale de sécurité du médicament (ANSM) : vérifier que, trois mois après la fin du traitement, le virus aura été contrôlé dans l’organisme et ne resurgira pas de plus belle, sous la forme d’un rebond viral. Pour valider cet effet bénéfique, les patients devront cesser leur traitement antirétroviral, ou trithérapie, pendant deux mois à l’issue des injections.
La cible : la protéine Tat
Les atouts de Tat Oyi
Portrait de Tat Oyi
La spécificité de cet essai clinique de vaccin thérapeutique anti-VIH, le seul en phase 2 actuellement en France (trois autres sont en cours à travers le monde) : il cible une protéine, appelée Tat (pour transactivating), qui protège l’accès, chez les personnes séropositives, des cellules infectées par le VIH et empêche ainsi leur système immunitaire de les attaquer. Pour contrecarrer cet effet néfaste de la protéine Tat, le vaccin mis au point depuis une quinzaine d’années, contient une protéine synthétique, dite Tat Oyi, qui correspond à un variant de la protéine ciblée. L’objectif est d’activer, grâce à Tat Oyi, le système immunitaire contre Tat, et de lui permettre ainsi de neutraliser Tat grâce à des anticorps. L’intérêt serait de pouvoir diminuer alors le recours aux trithérapies, dont les effets secondaires sont nombreux. Voire, en cas de succès, de pouvoir y renoncer.
En cas de succès de cette première étape, une deuxième phase visera, à l’horizon 2014, à démontrer l’efficacité du vaccin sur un groupe de patients statistiquement significatif, soit 80 patients répartis en deux groupes. Le premier serait alors vacciné avec la dose optimale de Tat Oyi, le second servant de placebo. Pour l’instant, trente patients seulement sur les 2000 qui se sont portés volontaires ont été retenus, car répondant aux critères drastiques du protocole placé sous la conduite du docteur Isabelle Ravaux. Des patients séropositifs qui doivent en particulier accepter de manière éclairée d’interrompre pendant deux mois leur trithérapie à l’issue des trois vaccinations, pour mesurer efficacement l’effet de cette dernière.
Les atouts de Tat Oyi
Si les chercheurs et les médecins restent très prudents, le vaccin, dont la fabrication a été confiée à l’entreprise Biosantech, présente plusieurs atouts. Les études menées sur le macaque ont ainsi montré sa capacité à contrôler l’infection, et semblent par ailleurs indiquer qu’il pourrait également avoir un effet préventif. Autre atout : pendant toute la phase de recherche fondamentale, le variant Tat Oyi a montré une étonnante capacité à reconnaître toutes les formes, très variées, de la protéine Tat. Autant d’espoirs qui seront confirmés, ou pas, par l’essai qui débute à Marseille. Premiers résultats attendus, dans une revue spécialisée, au mieux à la fin de l’année 2014.
Point sur les essais cliniques EVA TAT
Le 2 décembre 2013 - Biosantech, Informations, News, Programmes
PROMOTEUR BIOSANTECH SA
Biosantech Logo
(15 octobre 2013)
Après avoir obtenu l’Autorisation d’Essai Clinique délivrée le 24 janvier 2013 par l’Agence Nationale de Sécurité du Médicament, Biosantech SA a pu démarré la phase I de l’essai clinique de son vaccin contre le SIDA à partir de la Tat Oyi .Le 25 Mars 2013, la pré inclusion du premier patient a eu lieu, l’inclusion correspondant à la première injection ayant eu lieu le 10 avril.
Trois groupes de patients ont été vaccinés avec 3 doses différentes :11 µg, 33 µg et 99 µg du principe actif Tat Oyi . Un quatrième groupe (placébo) est vacciné avec le tampon du vaccin sans principe actif . Trois vaccinations sont effectuées à un mois d’intervalle (M0, M1 et M2) et sont faites de manière aléatoire en double aveugle.
Biosantech SA a obtenu le passage des essais cliniques de son vaccin thérapeutique en phase II /a le 2 septembre avec l’arrêt du traitement de la trithérapie chez le 1er patient pendant deux mois. L’objectif de la phase II/a est de déterminer quelle sera la dose la plus efficace entre des 3 concentrations de vaccin.
La phase I est à ce jour un succès total du fait qu’aucun effet indésirable après vaccination n’a été observé et qu’une réaction immunitaire anti Tat a été constatée chez des patients dès la 2ème vaccination.
Sachant qu’on observe après 3 semaines d’arrêt de trithérapie, on observe un rebond virémique chez 95 % des patients. L’objectif est qu’au moins 30% des patients
d’un des trois groupes soit capables de maintenir une virémie indétectable après 2 mois d’arrêt de trithérapie. Pour pouvoir commencer la phase IIb, il faut donc qu’au moins quatre patients d’un des trois groupes vaccinés avec le principe actif aient été capables de garder une virémie indétectable pendant 2 mois.
S’il existe une dose efficace, cette vaccination pourra être considérée comme un succès. Celui-ci sera validé sur un effectif statiquement significatif de 40 patients versus un groupe placebo. C’est l’objectif de la phase II/b.
Pour connaître le résultat de la phase II/a, il faut faire ce que l’on appelle la « levée de l’aveugle ». Cette levée de l’aveugle à lieu lorsque le dernier patient inclus sort de l’étude soit dans notre protocole un an (M12) après la première vaccination. On peut espérer une levée d’ aveugle par le comité de surveillance, fin d’année 2014 .
Le Dr Isabelle Ravaux (investigateur principal), en fonction des disponibilités des patients et des capacités du Centre d’Investigation Clinique (CIC) a fait la dernière inclusion mi- Novembre. On peut prévoir de commencer les pré- inclusions de la phase II b en juillet 2014. L’inclusion du dernier patient de la phase II b devrait avoir lieu fin décembre 2014.
Le laboratoire chargé d’analyser les critères secondaires des essais cliniques a réussi de novembre 2012 à Mai 2013 la synthèse de 5 variants de la protéine Tat avec leur activité biologique. Ces variants Tat ont été aliquotes et doivent servir avec Tat Oyi d’antigène pour tester la réponse sérologique à la vaccination. Depuis le début des essais cliniques, le laboratoire a recueilli au CIC des échantillons sanguins des patients de l’essai EVA TAT, le sérum a été extrait et stérilisé selon une procédure standardisée (SOP) mise au point au laboratoire avant le début des essais.. Cette SOP a permis des études sérologiques en juin 2013 sur des prélèvements J-15 et M2 qui ont confirmé chez certains patients une réponse anti Tat liée à la vaccination, ce qui a permis d’obtenir l’autorisation de passage en phase II/a de l essai clinique pour le vaccin.
Apres être parti avec 5 candidats vaccins en début d’ année , nous sommes le seul au monde à avoir eu l autorisation à passer en Phase II par notre comité de surveillance grâce aux anticorps produits suite aux vaccinations.
Corinne Muselier Treger.
Présidente Directrice Générale
Lutte contre le SIDA – Interview Pr Jean-Claude CHERMANN Institut I.I.S.D.R.S.I.®
Le 1 décembre 2013 - Biosantech, News
Lutte contre le SIDA – Interview Michel Paul CORREA Institut I.I.S.D.R.S.I.®
Le 1 décembre 2013 - Biosantech, News

SUCCESS STORIES

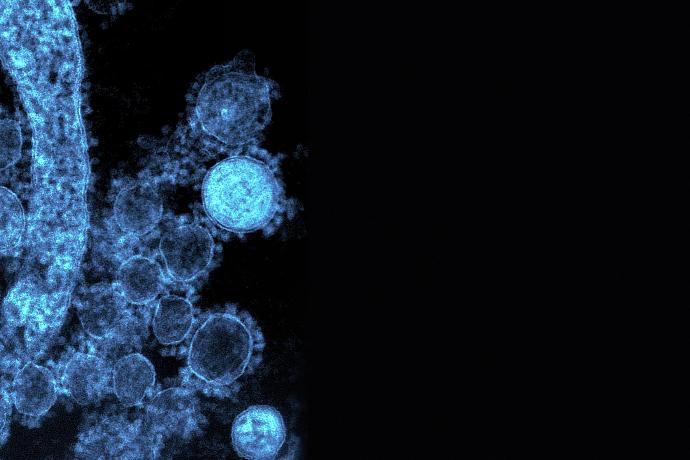
La protéine « TAT »
La voie de recherche de BIOSANTECH pour lutter contre le virus du sida est axée autour de la protéine « Tat »comme cible du vaccin car elle est
sécrétée de manière très précoce après l’infection par le virus et la « Tat extra cellulaires » est suspectée d’être la cause de l’effondrement de l’immunité cellulaire et du maintien des cellules réservoirs produisant le virus.
La protéine « Tat » est présente dans tous les types et sous types de VIH-1 présents sur les différents continents, son rôle est au niveau extracellulaire en empêchant l’élimination des cellules réservoirs par les cellules cytoxyques du système immunitaire (CAMPBELL & LORET 2009). Il a été montré dans des études cliniques, qu’il y avait une corrélation chez des patients entre la non progression vers le sida et la présence d’une réponse immunitaire contre « Tat ». La question importante est de comprendre pourquoi uniquement une minorité de patient développe une réponse anti-Tat efficace, permettant de devenir non-progresseur. Il semble que « Tat » possède des analogies de séquences avec des protéines humaines en particulier « la protamine » (RODMANN et Al.1993) ce qui empêche le système immunitaire de se défendre contre le virus lors de l’infection.
Une étude menée en 1989, sur une cohorte gabonaise de patients exposés au VIH-1 a montré que 23 gabonaises infectées sur 25, ont résisté au VIH-1 grâce à un variant « Tat » spécifique à cette région très immunogène. Cette souche du VIH- 1 spécifique appelée VHI-Oyi a montré que la seule différence avec le VIH classique était une mutation sur le gène « Tat ».

La protéine « TAT »
La voie de recherche de BIOSANTECH pour lutter contre le virus du sida est axée autour de la protéine « Tat » comme cible du vaccin car elle est sécrétée de manière très précoce après l’infection par le virus et la « Tat extra cellulaires » est suspectée d’être la cause de l’effondrement de l’immunité cellulaire et du maintien des cellules réservoirs produisant le virus.
Vaccin TATLa protéine « Tat » est présente dans tous les types et sous types de VIH-1 présents sur les différents continents, son rôle est au niveau extracellulaire en empêchant l’élimination des cellules réservoirs par les cellules cytoxyques du système immunitaire (CAMPBELL & LORET 2009). Il a été montré dans des études cliniques, qu’il y avait une corrélation chez des patients entre la non progression vers le sida et la présence d’une réponse immunitaire contre « Tat ». La question importante est de comprendre pourquoi uniquement une minorité de patient développe une réponse anti-Tat efficace, permettant de devenir non-progresseur. Il semble que « Tat » possède des analogies de séquences avec des protéines humaines en particulier « la protamine » (RODMANN et Al.1993) ce qui empêche le système immunitaire de se défendre contre le virus lors de l’infection.
Une étude menée en 1989, sur une cohorte gabonaise de patients exposés au VIH-1 a montré que 23 gabonaises infectées sur 25, ont résisté au VIH-1 grâce à un variant « Tat » spécifique à cette région très immunogène. Cette souche du VIH- 1 spécifique appelée VHI-Oyi a montré que la seule différence avec le VIH classique était une mutation sur le gène « Tat ».
Le séquençage ne révéla aucune anomalie, à l’exception du gène « Tat » où il a été noté une mutation de Cys 22 Ser. Cela semble être la raison de la perte de la transactivation (la réplication et l’infection par le virus) et la réversion de cette mutation permet de restaurer l’activité Tat (Péloponnèse & al. 1999). Ces patientes atypiques de la région du Haut Ogooué porteuses de ce gène « Tat » dénommé « Oyi » furent suivies pendant 2 ans et restèrent en bonne santé avec aucune perte de poids, ni de maladie opportuniste pendant les 2 ans de l’étude (Huet &al.1989).
La femme chez qui la souche VIH-1 Oyi a été prélevée était en parfaite santé en 1995 et a eu 3 enfants, tous séronégatifs (Eric Delaporte, communication personnelle). Le VHI-1 n’est plus détectable chez elle.
La voie de recherche BIOSANTECH
Biosantech a choisi de prendre la licence de développement et de commercialisation des brevets du vaccin à partir de la « Tat Oyi » qui possède une mutation de la Cys en Ser. Son principe actif est une protéine synthétique de forme longue à 101 résidus couvert par deux brevets déposés en 1999 et en 2008 par le CNRS et l’Université d’Aix-Marseille. Nous pensons que la « Tat Oyi » donnera une immunité contre tous les variants des VIH-1 présents sur les différents continents. La « Tat Oyi » possède un Epitope en 3D qui correspond très probablement à une région très conservée chez les différents « Tat ». Cet Epitope 3D est présent dans la « Tat Oyi » mais absent chez les protéines humaines en particulier « la protamine », ce qui expliquerait la réponse anti-Tat efficace des porteurs de cette souche particulière du virus VIH-1.
L’hypothèse BIOSANTECH83290870
La vaccination de patients séropositifs, par un principe actif synthétique dérivé du variant « Tat Oyi » de patients séropositifs aiderait leur système immunitaire à reconnaître les variants de la protéine « Tat » présents dans le sang. La neutralisation de la protéine « Tat extra cellulaire » permettrait la restauration de l’immunité cellulaire et l’élimination des cellules infectées par le VIH-1. La diminution des cellules infectées devrait avoir pour conséquence la stabilisation de la virémie chez les patients sans avoir besoin de trithérapie. La preuve d’efficacité de notre vaccin est de pouvoir maintenir une virémie en dessous de 40 copies/ml sans l’aide d’antiviraux pendant deux mois. Cette vaccination représenterait un bénéfice direct pour les patients séropositifs, leur permettant d’avoir une vie sociale normale et d’éviter les effets secondaires très lourds de la trithérapie.
Conclusion
L’hypothèse est que la vaccination avec un principe actif d’origine synthétique dérivé du variant « Tat Oyi » de patients séropositifs pourrait aider leur système immunitaire à reconnaitre les variantes de la protéine « Tat » présents dans le sang. La neutralisation de la protéine « Tat extracellulaire » permettrait de restaurer l’immunité cellulaire et l’élimination des cellules infectées par le VIH-1. Pour des patients vaccinés, elle pourrait permettre de maintenir une virémie de 50 copies/ml sans l’aide d’antiviraux. Cette vaccination représenterait un bénéfice direct pour les patients séropositifs.

Essais et protocole
Premiers résultats encourageants sur les macaques
Une publication montre que lors des essais sur les macaques, 7 macaques ont été immunisés avec « Tat Oyi » et ensuite infectés par le HIV un an après le début de l’immunisation, la publication a montré que le résultat de la vaccination avec la « Tat Oyi » a entraîné une baisse significative de la virémie pour 5 macaques sur 7, bien supérieure à celle des macaques vaccinés avec la tat toxoïde d’Aventis Pasteur. Le résultat le plus marquant de cette étude a été que les cellules réservoirs, n’étaient plus détectables pour les 7 macaques vaccinés avec la « Tat Oyi » et pour un des macaques, la virémie a été très faible car il est resté séronégatif. Il a été intéressant de constater que celui-ci a eu le plus fort taux d’anticorps anti-Tat par rapport aux 6 autres macaques. On a assisté pour ce macaque à la même séro-rétro conversion que dans l’étude sur la cohorte de patientes gabonaises. Etudes publiées dans la revue R retrovirology (watkins et al, 2006). Ces résultats sur l’animal ont été confirmés en par l’Université d’Harvard et une publication a confirmé que ce sont bien les anticorps contre la protéine « Tat » qui ont permis aux macaques vaccinés de résister au Virus.
Janvier 2013 : démarrage des essais cliniques
Les essais cliniques autorisés le 25 janvier 2013 sur 48 patients séropositifs ont eu lieu le 10 Avril 2013 au Centre d’Investigation Clinique de l’Hôpital de la Conception à Marseille, selon le protocole dont le numéro d’autorisation d’essais clinique est 2012-000374-36. Le médecin investigateur des essais cliniques phase I–II.a est le Docteur Isabelle Ravaux.
Protocole de l’essai clinique Protocole de l’essai clinique en cours
Phase I (réalisée avec succès)
La toxicité pré clinique sur le macaque a été faite à partir de 4 injections avec une dose de 100 microgramme et la période d’observation de 18 mois sur ce dernier permet d’indiquer qu’aucun effet secondaire n’a été observé sur le long terme (Watkins & Al.2006) .
Les essais cliniques ont été autorisés le 25 JANVIER 2013 par l’Agence Nationale de Sécurité du Médicament (ANSM) sur 48 PATIENTS SEROPOSITIFS et ont eu lieu au Centre d’Investigation Clinique de l’Hôpital de la Conception à Marseille.
Cet essai étant un succès, le comité de surveillance du vaccin a donné l’autorisation à la société BIOSANTECH de passer en phase II.
Phase II (En cours)
Phase II.a
Celle-ci a commencé le 2 SEPTEMBRE 2013 avec l’arrêt du traitement antiviral pour le premier patient pendant 2 MOIS. L’objectif de la phase II.a est de déterminer QUELLE DOSE SERA LA PLUS EFFICACE SUR LES 48 PATIENTS VACCINES
Phase II.b
L’objectif de cette phase est de vérifier sur un plus grand nombre de patients (80), l’absence d’effets indésirables, la production d’anticorps anti-Tat et une virémie indétectable après 2 mois d’arrêt de trithérapie.
A ce stade, le but de Biosantech est de pouvoir disposer des résultats intermédiaires au début du 2nd trimestre 2014 et faire le point sur les avantages apportés aux patients par un vaccin ou un traitement antiviral à partir de Tat Oyi.
Si 30 % des patients ont des anticorps capables de faire une reconnaissance croisée contre les variants Tat et que 30 % des patients (groupe vaccin) maintiennent une virémie inférieure à 40 copies/ml après deux mois d’interruption du traitement antirétroviral, BIOSANTECH testera le vaccin selon les normes ONU SIDA.
Phase III OU « ETUDE PIVOT »
Dans le cadre du test du vaccin selon les normes ONU SIDA, cette phase correspond à l’étude comparative d’efficacité proprement dite. Elle compare le traitement soit à un placebo, soit à un traitement de référence importante. Sans traitement de référence, il se peut, en raison des enjeux bénéfices/risques de la mise au point d’un vaccin, que cette phase soit très raccourcie sous la pression des pays dont la population est fortement contaminée.
L’hypothèse BIOSANTECH
La vaccination de patients séropositifs, par un principe actif synthétique dérivé du variant « Tat Oyi » de patients séropositifs aiderait leur système immunitaire à reconnaître les variants de la protéine « Tat » présents dans le sang. La neutralisation de la protéine « Tat extra cellulaire » permettrait la restauration de l’immunité cellulaire et l’élimination des cellules infectées par le VIH-1. La diminution des cellules infectées devrait avoir pour conséquence la stabilisation de la virémie chez les patients sans avoir besoin de trithérapie. La preuve d’efficacité de notre vaccin est de pouvoir maintenir une virémie en dessous de 40 copies/ml sans l’aide d’antiviraux pendant deux mois. Cette vaccination représenterait un bénéfice direct pour les patients séropositifs, leur permettant d’avoir une vie sociale normale et d’éviter les effets secondaires très lourds de la trithérapie.
Conclusion
L’hypothèse est que la vaccination avec un principe actif d’origine synthétique dérivé du variant « Tat Oyi » de patients séropositifs pourrait aider leur système immunitaire à reconnaitre les variantes de la protéine « Tat » présents dans le sang. La neutralisation de la protéine « Tat extracellulaire » permettrait de restaurer l’immunité cellulaire et l’élimination des cellules infectées par le VIH-1. Pour des patients vaccinés, elle pourrait permettre de maintenir une virémie de 50 copies/ml sans l’aide d’antiviraux. Cette vaccination représenterait un bénéfice direct pour les patients séropositifs.
e.
BIOSANTECH, créée en avril 2011 par Roger et Corinne TREGER est une entreprise innovante basée à Sophia Antipolis Valbonne en région Provence-Alpes Cote d’Azur.
BIOSANTECH a pour but de promouvoir et de développer un vaccin efficace sur tous les variants du virus du SIDA.
BIOSANTECH possède un accord exclusif de coopération avec le CNRS et l’université d’Aix Marseille et est propriétaire de la licence exclusive de valorisation et de commercialisation des brevets du CNRS concernant la TAT oyi. BIOSANTECH, possède à ce jour le seul vaccin thérapeutique au monde à avoir été autorisé à passer en phase II sur III nécessaire à sa commercialisation. Les résultats de la preuve de l’efficacité du vaccin sur des patients infectés par le SIDA sont en cours.
IIDSRI
CAUTION SCIENTIFIQUE DU PROJET
Le projet de BIOSANTECH a reçu le soutien de l’Institut International pour le Développement et le Soutien en Recherche Innovante (IIDSRSI) dirigé par Michel-Paul Correa et de son comité scientifique présidé par le Pr CHERMANN qui est constitué de 13 chercheurs et experts reconnus à l’International.
Le Docteur JEAN DE MAREUIL, immunologue et virologue est le conseiller scientifique du projet pour Biosantech et a la charge d’analyser les données biologiques à partir des sérums prélevés sur les patients vaccinés.
